13.08.2008
Ein Sandwich zu vielfältigem Gebrauch
Thioesterase-Enzym ermöglicht reibungslose Antibiotikasynthese
Marburger Biochemiker haben gemeinsam mit Kollegen die dreidimensionale Gestalt eines Enzyms aufgeklärt, das Bakterien zur Herstellung von Antibiotika und Fungiziden benötigen. Die Thioesterase-II besitzt ein leicht zugängliches aktives Zentrum, wodurch sie mit einer Vielfalt anderer Strukturen interagieren kann.
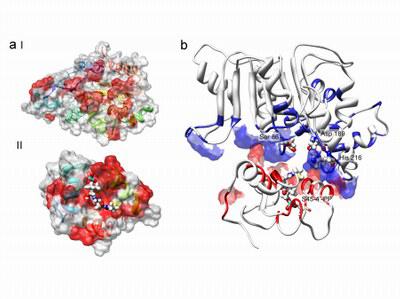
Die Wissenschaftler um Professor Dr. Mohamed A. Marahiel von der Philipps-Universität und seinen Frankfurter Kollegen Professor Dr. Volker Dötsch beschreiben nun die dreidimensionale Struktur des Reparaturenzyms. Auffällig sind die markanten Unterschiede zu der ansonsten sehr ähnlichen Thioesterase vom Typ I, die sich auf die andersartigen Funktionen zurückführen lassen. Die Biochemiker zeigen, dass die von ihnen untersuchte Thioesterase-II in zwei verschiedenen Konformationen vorliegt. Nur eine davon interagiert mit derjenigen Untereinheit des Enzymkomplexes, an die der fehlerhafte Kofaktor gebunden ist, der T-Domäne.
Die Autoren vermuten, dass es sich bei den beiden Konformationen um einen offenen und einen geschlossenen Zustand der Thioesterase-II handelt. Dabei ist das aktive Zentrum des Enzyms in eine flache Grube eingebettet. Dem vorgeschlagenen Modell zufolge befindet sich der Kofaktor eingekeilt zwischen Thioesterase-II und T-Domäne, wie bei einem Sandwich. "Die Form folgt der Funktion", erläutert Mitverfasser Marahiel: Das vergleichsweise frei zugängliche aktive Zentrum "ermöglicht eine eher unspezifische, aber unverzichtbare Reparaturfunktion". Die Forscher veröffentlichen ihre Ergebnisse in der neuesten Ausgabe des Wissenschaftsmagazins "Nature".
Originalveröffentlichung: Alexander Koglin, Frank Löhr, Frank Bernhard, Vladimir R. Rogov, Dominique P. Frueh, Eric R. Strieter, Mohammad R. Mofid, Peter Güntert, Gerhard Wagner, Christopher T. Walsh, Mohamed A. Marahiel & Volker Dötsch: Structural basis for the selectivity of the external thioesterase of the surfactin synthetase, Nature, 14. August 2008, doi:10.1038/nature07161
Weitere Informationen:
Ansprechpartner: Professor Dr. Mohamed A. Marahiel,
Fachbereich Chemie
Tel.: 06421
28-25722
E-Mail:
marahiel@staff.uni-marburg.de
Internet:
www.uni-marburg.de/fb15/ag-marahiel?language_sync=1