09.09.2011
Mit dem Lasso auf der Jagd nach Wirkstoffen
Marburger Forscher erzeugen neue Plattform für künftige Medikamente
Schlingenförmig gewundene Biomoleküle eignen sich als Gerüste, um gezielt Medikamente zu konstruieren. Das schließen Marburger Biochemiker und ihre Kollegen aus Untersuchungen an so genannten Lasso-Peptiden; die Ergebnisse sind in der aktuellen Ausgabe des Fachblatts „Angewandte Chemie“ erschienen.
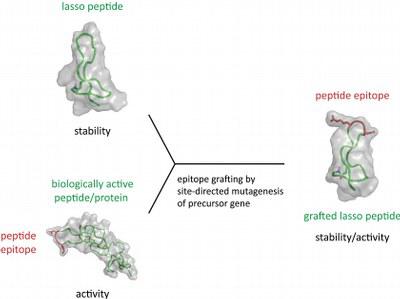
„Lasso-Peptide vereinen in sich einzigartige Eigenschaften, die sie zur Anwendung als robustes Gerüst prädestinieren“, stellt das Autorenteam um Professor Dr. Mohamed A. Marahiel von der Philipps-Universität fest: Neben der namengebenden Schlingenform zeichnen sich die Verbindungen unter anderem dadurch aus, dass sie gegenüber Umwelteinflüssen wie Temperatur und Chemikalien stabil sind; sie können vom Bakterium Escherichia coli erzeugt werden, einem Mikroorganismus, der in Forschungslaboratorien und biotechnologischen Industriebetrieben standardmäßig als Bioreaktor Verwendung findet; nicht zuletzt erfolgt ihre Herstellung durch eine zelluläre Maschinerie, die anpassungsfähig genug ist, um den Austausch von Bausteinen zuzulassen.
Marahiels Arbeitsgruppe an der Philipps-Universität wählte das Peptidmotiv RGD, um es in ein Lassopeptid einzufügen. Die eingefügte Struktur ist in der Lage, so genannte Integrine zu binden; dabei handelt es sich um Proteine, die als Ziele für neuartige Medikamente dienen können. Integrine sorgen zum Beispiel dafür, dass Tumore mit Blutgefäßen versorgt werden.
Wie die Wissenschaftler aus Marburg, München, Braunschweig und Saudi-Arabien nachweisen konnten, bindet das von ihnen erzeugte Konstrukt „MccJ25 RGD“ tatsächlich an einige der möglichen Zielmoleküle. Je nach Konzentration verhindert die künstliche Verbindung außerdem, dass Blutgefäße gebildet werden. Sie erwies sich darüber hinaus als stabil gegenüber schädlichen Umwelteinflüssen. "Unsere Daten zeigen, dass wir im Prinzip in der Lage sind, ein Lasso-Gerüst zu konstruieren, um einen Integrin-Inhibitor zu erzeugen", resümiert Senior-Autor Marahiel. "Dieser Ansatz kann auch zum Einsatz kommen, um andere Wirkstoffe herzustellen, die auf Lasso-Strukturen beruhen. Wir kennen bereits weitere Beispiele bioaktiver Peptid-Oberflächen, die in Lassopeptid-Gerüste eingebaut werden können."
Originalveröffentlichung: Thomas A. Knappe & al.: Introducing Lasso Peptides as Molecular Scaffolds for Drug Design: Engineering of an Integrin Antagonist, Angewandte Chemie 50 (2011), 8714-8717, DOI: 10.1002/anie.201102190
Weitere Informationen:
Ansprechpartner: Professor Dr. Mohamed A. Marahiel,
Fachgebiet Biochemie
Tel.: 06421 28-
25722
E-Mail:
marahiel@staff.uni-marburg.de