01.10.2012
Die Schleife macht den Unterschied
Feinste Molekülstrukturen beeinflussen die Einnistung krankmachender Pilze
Wissenschaftler aus Marburg und Stuttgart haben herausgefunden, wie sich krankmachende Pilze in den Schleimhäuten ihrer Wirte einnisten – und wie sie die Oberflächen medizinischer Geräte verpesten. Die Forscher veränderten die Struktur von Proteinen, die dafür verantwortlich sind, dass sich die Pilzzellen am Wirtsgewebe anheften; minimale Veränderungen reichen aus, um die Bindungspartner zu wechseln, berichten die Forscher um Professor Dr. Lars-Oliver Essen und Professor Dr. Hans-Ulrich Mösch in der Wissenschaftszeitschrift PNAS. Die Autoren hoffen, dass ihre Ergebnisse zu neuen Medikamenten führen, mit denen sich die Einnistung der Pilze verhindern lässt.
(Abbildung: Philipps-Universität / AG Essen)
„Unsere Untersuchungen decken auf, welche Strukturen darüber entscheiden, wo sich die Oberflächenproteine der Pilze anheften und wo nicht“, erklärt der Biochemiker Lars-Oliver Essen vom Biomedizinischen Forschungszentrum der Philipps-Universität, der als Seniorautor der Studie firmiert. Pilzinfektionen sind eine häufige Krankheitsursache und beruhen auf dem Vermögen der Einzeller, sich an Schleimhäute und Epithelien ihrer Wirte anzuheften. Der Hefepilz Candida glabrata befällt den Urogenitaltrakt und die Blutbahn von Patienten, deren Immunsystem geschwächt ist; für die Betroffenen kann eine Infektion zum Tode führen. „Herkömmliche Medikamente gegen Pilze haben sich als wirkungslos erwiesen, so dass die Wirkstoff-Forschung fieberhaft nach Alternativen sucht“, erläutert Mitverfasser Hans-Ulrich Mösch vom Institut für Genetik der Philipps-Universität.
Der Mikroorganismus kann vermutlich deshalb so schnell neue Wirtsgewebe besiedeln, weil sich seine Anheftungsproteine besonders effektiv an neue Umweltanforderungen anpassen – so bildet Candida beispielsweise Biofilme auf Harnkathetern. Anheftungsproteine gelten daher als bevorzugte Ziele für neue Therapieansätze, um den Pilz zu bekämpfen. Die meisten dieser so genannten EPA-Proteine (Epitheliale Adhäsine) sind jedoch chemisch und biologisch nur unzureichend charakterisiert.
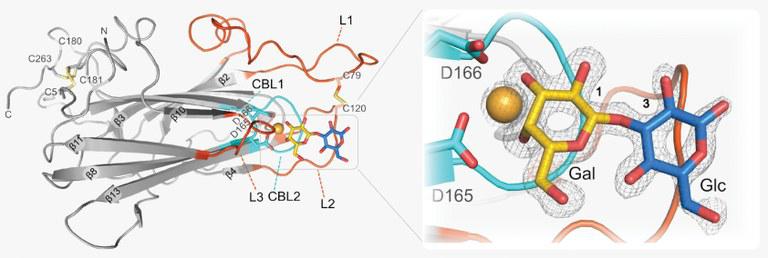
Damit sich Candida in die Schleimhaut einnisten kann, interagieren die Anheftungsproteine des Pilzes mit ganz bestimmten Zuckermolekülen wie Laktose oder Galaktose, die auf der Oberfläche von Wirtsepithelien oder Schleimhäuten verankert sind. Die Stuttgarter Koautoren um Dr. Steffen Rupp vom Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB untersuchten dies mit Hilfe von Schleimhautmodellen direkt im Reagenzglas. Wie die Proteinstruktur im Detail aussieht, analysierten die Marburger Wissenschaftler und ihre Kollegen am Beispiel des Adhäsins EPA1. Für die Wahl des richtigen Bindungspartners sind drei schleifenförmige Abschnitte des Proteins verantwortlich, die eine Tasche bilden, in die das Zuckermolekül genau passt – kleinste Abweichungen in der Schleifenstruktur bewirken, dass andere Zuckermoleküle gebunden werden.
Die Forscher präsentieren Varianten von EPA1, die an ähnlichen Stellen binden wie die nah verwandten Proteine EPA2, EPA3 und EPA6. „Aufgrund unserer Befunde könnten einmal Wirkstoffe entwickelt werden, die gegen Pilzbefall helfen, indem sie eine Anheftung an die Schleimhaut verhindern“, hoffen die Autoren.
Die Arbeit der Wissenschaftler wurde durch die Deutsche Forschungsgemeinschaft sowie im Rahmen des Zentrums für Synthetische Mikrobiologie der hessischen Landesexzellenzinitiative „LOEWE“ finanziell gefördert.
Online-Vorabveröffentlichung:
Manuel Maestre-Reyna
& al.: Structural basis for promiscuity and specificity during
Candida glabrata
invasion of host epithelia, Proc. Natl. Acad.
Sc. USA Early Online Edition (2012), DOI:10.1073/pnas.1207653109,
URL:
http://www.pnas.org/content/early/2012/10/02/1207653109.abstract
Weitere Informationen:
Ansprechpartner: Professor Dr. Hans-Ulrich Mösch,
Fachgebiet Molekulare Genetik
Tel.: 06421 28-23013, -23497 (Arbeitsgruppe)
E-Mail:
moesch@staff.uni-marburg.de