28.02.2012
Chemie, radikal anders
Marburger Wissenschaftler postulieren neuen Mechanismus für Antibiotika-Biosynthese
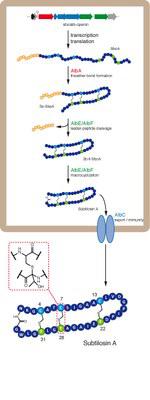
Das Ringmolekül ist aus einer Kette von Aminosäuren zusammengesetzt und wird als Peptid bezeichnet. „Sactibiotics sind eine neuartige Klasse von ungewöhnlichen Peptid-Antibiotika“, erklärt Professor Dr. Mohamed A. Marahiel von der Philipps-Universität, der die aktuelle Veröffentlichung in der Online-Ausgabe des Wissenschaftsmagazins „Nature Chemical Biology“ als Seniorautor verantwortet. Diese Peptide enthalten eine besonders stabile Brücke zwischen zwei gegenüber liegenden Aminosäuren, die nicht durch die chemische Reaktion von Säuren gespalten werden kann.
„Dieses außergewöhnliche Strukturmotiv ist nicht mit den heutigen Methoden der organischen Chemie zu synthetisieren“, führt der Marburger Hochschullehrer aus. „Um neuartige Peptidantibiotika künstlich zu erzeugen, ist es daher besonders wichtig, zu verstehen, wie die Natur diese molekularen Vorgänge ermöglicht.“
Die Wissenschaftler fanden heraus, dass die stabilen Verknüpfungen im ersten Schritt der Biosynthese eingeführt werden. Des Weiteren zeigt die aktuelle Studie, dass ein neu entdecktes Enzym für die Bildung der Brücken verantwortlich ist, genannt „AlbA“. Es gehört der Klasse der „Radical SAM Enzymen“ an, die Eisen-Schwefel-Kerne enthalten und dadurch in der Lage sind, ihre Zielverbindung „SAM“ (S-Adenosylmethionin) zu spalten; dabei entsteht ein so genanntes Radikal (5’-Deoxyadenosylradikal), das für die eigentliche Reaktion verantwortlich ist.
Indem die Marburger Forscher eine Wechselwirkung zwischen einem der enthaltenen Eisen-Schwefel-Kerne und dem Vorläufer des Ringmoleküls nachweisen konnten, ist es erstmals möglich geworden, einen Mechanismus vorzuschlagen, der die Bildung der genannten Verknüpfungen erklärt. „Dieser Mechanismus ist einzigartig für die Entstehung solcher Brücken, da er auf der katalytischen Wirkung eines Radikals beruht, das am Ort der Reaktion entsteht“, fasst Marahiel die Bedeutung der Ergebnisse zusammen.
Originalveröffentlichung: Leif Flühe & al.: The radical SAM enzyme AlbA catalyzes thioether bond formation in subtilosin A. Nature Chemical Biology 2012, doi:10.1038/nchembio.798
Weitere Informationen:
Professor Dr. Mohamed A. Marahiel,
Fachgebiet Biochemie
Tel.: 06422 28-25722, Sekretariat: -25715
E-Mail:
marahiel@staff.uni-marburg.de
Internet:
http://www.uni-marburg.de/fb15/ag-marahiel?language_sync=1