12.07.2013
Löcher an zwei Stellen stopfen
Physiologen klären auf, wie Zellporen wirkungsvoll blockiert werden
Doppelt gebunden hemmt besser: Kleine Moleküle verschließen Zell-Poren wirkungsvoll, wenn sie an zwei Stellen der Proteine anhaften, aus denen die Poren aufgebaut sind. Das hat ein Team von Forscherinnen und Forschern unter Marburger Leitung herausgefunden. Die Wissenschaftlerinnen und Wissenschaftler um Professor Dr. Niels Decher, Stefanie Marzian und Dr. Susanne Rinné von der Philipps-Universität berichten über ihre Ergebnisse in der aktuellen Ausgabe des Fachmagazins „Nature Chemical Biology“.
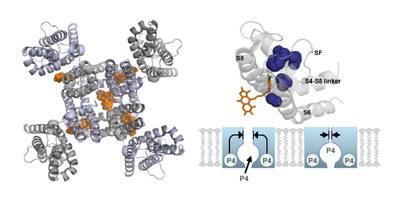
(Abbildung: Autoren / AG Decher)
Zellen sind von Membranen umhüllt, die als Schutz dienen und den Austausch mit anderen Zellen oder der Umwelt vermitteln. Die Zellmembran enthält hierfür Ionenkanäle, durch die Partikel nach innen oder außen gelangen, sofern ihre Art, Größe und elektrische Ladung dies zulassen. Dieser Stoffaustausch ist strikt reguliert. „Blockiert man Ionenkanäle mit speziellen Wirkstoffen, so lassen sich Krankheiten wie Herzrhythmusstörungen, Multiple Sklerose oder Parkinson behandeln“, sagt der Marburger Physiologe Niels Decher, der die vorliegende Studie leitete; „die aktuelle medizinische Forschung arbeitet deshalb daran, solche Pharmaka zu entwickeln“.
Soweit bisher bekannt ist, verstopfen derartige Wirkstoffe das Innere der Ionenkanalpore, der zentralen Öffnung des Kanals. Obwohl es eine Vielzahl an Ionenkanälen gibt, ist diese Pore bei ihnen allen nahezu identisch aufgebaut. „Bisher galt es als fast unmöglich, bestimmte Ionenkanäle selektiv zu blockieren“, erläutert Decher den Ausgangspunkt der aktuellen Studie.
Die Wissenschaftlerinnen und Wissenschaftler identifizierten eine neue Bindungsstelle für den Wirkstoff Psora-4, einen bekannten Hemmstoff von Kaliumkanälen. Dessen Moleküle besetzen ebenfalls einen Abschnitt der Kanalpore, der sich bei allen Ionenkanälen ähnelt. Wie die Forscherinnen und Forscher entdeckten, haftet Psora-4 aber zusätzlich an einer Seitentasche außerhalb der Kanalpore; diese Kontaktstelle unterscheidet sich bei verschiedenen Typen von Ionenkanälen. „Der bislang unbekannte Mechanismus eröffnet unerwartete und vielversprechende Möglichkeiten, Medikamente zu entwickeln, die spezifischer wirken und daher weniger unerwünschte Nebenwirkungen haben als bisherige Arzneimittel“, hebt Decher hervor.
Die Untersuchungen der Autoren wurden im Rahmen der überregionalen Forschergruppe FOR 1086 der Deutschen Forschungsgemeinschaft durchgeführt, die dem Thema „K 2P -Kanäle – vom Molekül zur Physiologie und Pathophysiologie“ gewidmet ist. Neben Dechers Arbeitsgruppe am Institut für Physiologie und Pathophysiologie der Philipps-Universität beteiligten sich an der Studie die Arbeitsgruppe von Professor Dr. Thomas Baukrowitz von der Christian-Albrechts-Universität zu Kiel, Klaus Steinmeyer vom Pharmaunternehmen Sanofi aus Frankfurt am Main sowie weitere europäische und US-amerikanische Wissenschaftlerinnen und Wissenschaftler.
Originalveröffentlichung: Stefanie Marzian & al.: Side pockets provide the basis for a new mechanism of Kv channel–specific inhibition, Nature Chemical Biology 8 (2013), DOI: 10.1038/nchembio.1271
Weitere Informationen:
Ansprechpartner: Professor Dr. Niels Decher,
Fachgebiet
Physiologie
Tel.: 06421 28-62148
E-Mail:
decher@staff.uni-marburg.de
AG Decher im Internet: http://www.uni-marburg.de/fb20/physiologie/ags/decher/index_html
Forschergruppe FOR 1086 im Internet:
http://for1086.uni-muenster.de/indexe.html
Medieninformation zur Forschergruppe FOR 1086:
http://www.uni-marburg.de/aktuelles/news/2011/0826a