07.08.2015
Gestörtes Recycling macht Krebszellen aggressiv
Das Zellgerüst muss mitspielen, damit Zellen aneinander haften
Zusammenhalten gegen Krebs: Anheftungsproteine interagieren gezielt mit dem Zellgerüst, um die Beweglichkeit von Tumorzellen zu fördern. Das zeigen Wissenschaftlerinnen und Wissenschaftler aus Marburg, Göttingen, Heidelberg und Turku (Finnland), indem sie den zugrunde liegenden Mechanismus beschreiben. Wenn die beteiligten Verbindungen nicht richtig zusammenwirken, können sich Krebserkrankungen ausbreiten. Das Team um Professor Dr. Robert Grosse berichtet über ihre Ergebnisse in der neuesten Ausgabe des Fachblatts „Developmental Cell“.
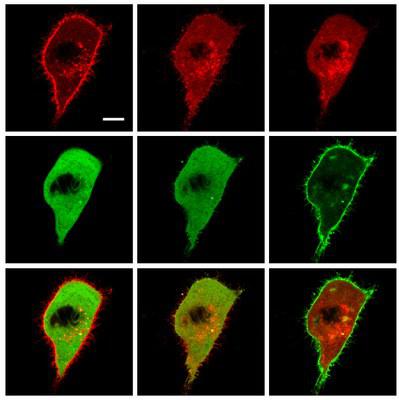
Zellen tragen an ihrer Außenhülle Proteine wie Integrin, die sich an die Zellumgebung heften. Von Zeit zu Zeit wird Integrin ins Zellinnere transportiert und in Bläschen verpackt, um später wiederverwendet zu werden. „Ist das Recycling von Integrin gestört oder erhöht, so erleichtert dies das Wachstum von Tumoren sowie die Bildung von Metastasen“, erläutern die Autoren.
Die Transportbläschen bewegen sich entlang des Zellgerüsts, als würden sie von Zugseilen gezogen. Welche Moleküle wirken als Vermittler zwischen Zellgerüst und Integrin-Recycling? Die Wissenschaftler gingen dieser Frage nach, indem sie das Protein Formin-like 2 (FMNL2) unter die Lupe nahmen, das zum Knüpfen der molekularen Zugseile beiträgt; FMNL2 ist besonders stark bei Krebsformen aktiviert, die Metastasen bilden.
Die Autoren verfolgten die Lokalisierung der beteiligten Moleküle und blockierten deren Aktivität, um herauszufinden, welche Funktion sie im Normalfall erfüllen. Das Team fand heraus: Wird FMNL2 chemisch modifiziert, indem Phosphatgruppen angehängt werden, so verändert sie dessen Funktion und das Molekül wandert von der Außenhülle der Zelle zu den Bläschen in deren Innerem. Wenn man die Verbindung künstlich stilllegt, wird das Anheftungsprotein Integrin nicht in Bläschen verpackt.
„Unsere Daten legen nahe, dass die Phosphorylierung von FMNL2 als eine Art molekularer Schalter wirkt, um den innerzellulären Transport von Integrin zu steuern, wenn Krebszellen in gesundes Gewebe eindringen“, fassen die Autoren ihre Ergebnisse zusammen. „Es ist vorstellbar, dass dieser Mechanismus angeschaltet bleibt, wenn es zur Ausbreitung einer Krebserkrankung kommt: die betroffenen Zellen heften sich dann nicht aneinander, sondern an das Proteingemisch, das zwischen den Zellen liegt.“ Da FMNL2 in diesem Prozess eine entscheidende Funktion erfüllt, bietet es dem Autorenteam zufolge möglicherweise einen attraktiven Ansatzpunkt, um therapeutisch einzugreifen und die Phosphorylierung pharmakologisch zu hemmen.
Professor Dr. Robert Grosse ist Direktor des Pharmakologischen Instituts am Fachbereich Medizin der Philipps-Universität und leitet einen Arbeitsbereich am Biochemisch-Pharmakologischen Centrum der Philipps-Universität. Neben Grosses Arbeitsgruppe und Forschern des Marburger LOEWE-Zentrums für Synthetische Mikrobiologie um Gert Bange sind Partnerinnen und Partner von der Universität Heidelberg, vom Max-Planck-Institut für Biophysikalische Chemie in Göttingen sowie von der Universität Turku an der Studie beteiligt. Die zugrunde liegende Forschungsarbeit wurde unter anderem durch die Deutsche Forschungsgemeinschaft sowie die Deutsche Krebshilfe finanziell gefördert.
Originalveröffentlichung: Ying Wang & al.: FMNL2 regulates β1-integrin and cell invasion, Devel. Cell 2015
Homepage: www.bpc-marburg.de/cytoskeletal-signaling-grosse-lab/
Kontakt
Professor Dr. Robert Grosse
Pharmakologisches Institut und Biochemisch-Pharmakologisches Centrum Marburg
Tel.:
06421 28-65001 (Sekretariat)
E-Mail