26.11.2021 Handschlag besiegelt Bildung von Eisen-Schwefel-Clustern
Internationales Team klärt abschließenden Produktionsschritt eines Proteinkomplexes der Mitochondrien auf
Ein Handschlag besiegelt den Abschluss: Eine deutsch-kanadische Forschungsgruppe hat einen noch im Dunklen liegenden Reaktionsschritt aufgeklärt, der zur Entstehung von Eisen-Schwefel-Clustern beiträgt – diese braucht der Körper zum Beispiel für die zelluläre Atmung und viele lebenswichtige Stoffwechselvorgänge. Wie das Team im Wissenschaftsmagazin „Nature Communications“ berichtet, treten Eisen und Schwefel zum Cluster zusammen, indem die Proteine, auf denen sie sitzen, sich durch Vermittlung einer einzigen Aminosäure zusammenschließen.
„Enzyme mit Eisen-Schwefel-Clustern sind unersetzlich für zahlreiche essenzielle Lebensprozesse“, erläutert der Marburger Biochemiker und Zellforscher Professor Dr. Roland Lill, der die Studie leitete. Beispiele hierfür sind insbesondere die Energiegewinnung in den Mitochondrien, die Vervielfältigung der Erbsubstanz DNA sowie deren Reparatur nach Schädigungen. Ist die Synthese von Eisen-Schwefel-Clustern gestört, kommt es zu schwerwiegenden Beeinträchtigungen der Gesundheit, etwa zu Blutarmut oder neurologischen Erkrankungen – bis hin zum Tod.
Die Entstehung von Eisen-Schwefel-Proteinen ist ein mehrstufiger Prozess, der das Zusammenwirken spezialisierter Enzyme erfordert; er findet zum großen Teil in den Mitochondrien statt, die als die Kraftwerke der Zelle gelten. „Das Ineinandergreifen der molekularen Vorgänge gleicht dabei den Abläufen in einer komplizierten Maschine“, sagt Lill. In der ersten Phase entsteht eine Verbindung aus zwei Eisen- und zwei Schwefelatomen, ein so genannter [2Fe-2S]-Cluster. Schon dieser Vorgang erfordert eine ganze Kette von Reaktionen. Lill arbeitet mit vielen nationalen und internationalen Wissenschaftlerinnen und Wissenschaftlern seit zwei Jahrzehnten daran, den Prozess Schritt für Schritt bis in die mechanistischen Details aufzuklären.
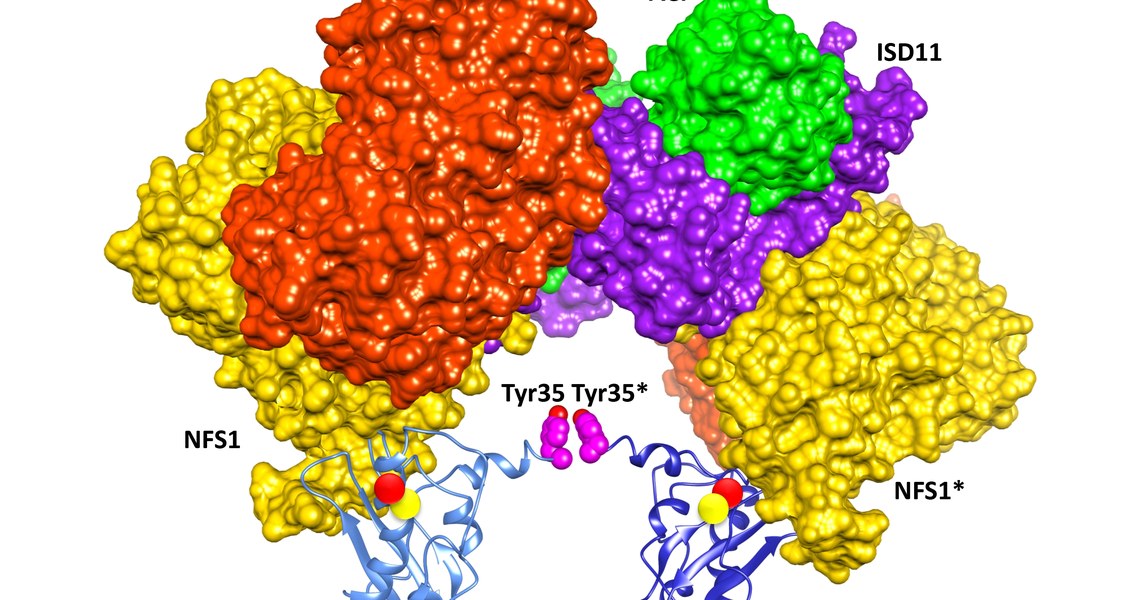
Das Zusammenschmieden von Eisen und Schwefel in den Mitochondrien findet auf speziellen Gerüstproteinen statt. In menschlichen Zellen übernimmt diese Aufgabe ein Paar von ISCU2-Proteinen, die am Ende des Prozesses durch eine [2Fe-2S]-Brücke verbunden sind. „Wie aus Eisen und Schwefel, die an ISCU2 gebunden sind, ein [2Fe-2S]-Cluster entsteht, war bislang noch weitgehend unbekannt“, erklärt Lills Mitarbeiter Dr. Sven-Andreas Freibert, einer der Leitautoren der Fachveröffentlichung.
Die Forschungsgruppe konzentrierte sich auf einen einzelnen Baustein des ISCU2-Proteins, nämlich auf die Aminosäure Tyrosin an Position 35. Wie wichtig die Aminosäure an dieser Stelle ist, zeigen Experimente an Zellkulturen: In Zellen mit ISCU2, dem das Tyr35 fehlt, sinkt der Pegel wichtiger Eisen-Schwefel-Proteine der Mitochondrien. Dies lässt sich rückgängig machen, indem man ISCU2 mit korrektem Tyr35 wieder künstlich einfügt.
Das Team um Lill führte biochemische und zellbiologische Experimente durch, die den Mechanismus aufzeigen, durch den die Aminosäure die Vermählung von Eisen und Schwefel zuwege bringt: Demnach gehen zwei Tyr35 unterschiedlicher ISCU2-Proteine eine Verbindung ein – Lill vergleicht das mit einem Handschlag –, wodurch auch die Eisen- und Schwefelatome zu einem [2Fe-2S]-Cluster verschmelzen.
Dass Tyr35 eine solche Scharnierfunktion übernimmt, belegt ein weiteres Experiment des Teams. Dabei setzte es zwei ISCU2-Proteine ein, bei denen Tyr35 gegen andere Aminosäuren ausgetauscht wurde, die entgegengesetzte elektrische Ladungen tragen. Ist deren gegenseitige Anziehung in der Lage, den vermuteten Kontakt zwischen zwei Tyr35 der beiden ISCU2-Proteine zu ersetzen? Einzeln eingesetzt, unterstützen diese Proteine die Clusterbildung nicht; mischt man die beiden Proteine mit den unterschiedlich geladenen Gruppen hingegen, so übernimmt die elektrische Anziehung die Funktion, die ansonsten der Tyr35-Handschlag ausübt. Das führt dazu, dass [2Fe-2S]-Cluster entstehen – fast wie in normalen, unveränderten Zellen.
„Wir haben die Beschreibung des Prozesses, durch den Eisen-Schwefel-Cluster entstehen, damit bis auf eine einzelne Aminosäure heruntergebrochen“, fasst Lill zusammen. Dies erlaube es nunmehr, den molekularen Mechanismus für den gesamten Zyklus der [2Fe-2S]-Clusterbildung in den Mitochondrien zu beschreiben.
Professor Dr. Roland Lill leitet das Institut für Zytobiologie und Zytopathologie der Philipps-Universität und gehört dem Marburger „LOEWE-Zentrum für Synthetische Mikrobiologie“ an. Im Jahr 2003 erhielt der Biochemiker den Leibnizpreis, den am höchsten dotierten deutschen Wissenschaftspreis; seit 2016 fördert die Deutsche Forschungsgemeinschaft Lills Arbeit durch das Reinhard-Koselleck-Programm, das besonders wagnisreiche Forschungsprojekte unterstützt. Demnächst übernimmt Lill das Vizepräsidentenamt der Von Behring-Röntgen-Stiftung, die ihn für sein Lebenswerk mit der Von Behring-Röntgen-Medaille auszeichnete.
Die Publikation ging aus einer engen Kooperation zwischen Lills Arbeitsgruppe und kanadischen Wissenschaftlern von der University of Saskatchewan hervor, die wichtige strukturbiologische Beiträge lieferten. Die Deutsche Forschungsgemeinschaft, die hessische Förderinitiative „LOEWE“, die Von Behring-Röntgen-Stiftung und das europäische COST-Programm unterstützten die Forschungsarbeit finanziell.
Originalveröffentlichung: Sven A. Freibert, Michal T. Boniecki & al.:
N-terminal tyrosine of ISCU2 triggers [2Fe-2S] cluster synthesis by ISCU2 dimerization, Nature Communications 2021,
DOI: https://doi.org/10.1038/s41467-021-27122-w