Hauptinhalt
Funktion chemosensorischer Bürstenzellen
Vor über 50 Jahren wurde durch elektronenmikroskopische Untersuchungen ein neuer Zelltyp im Epithel der Gallenwege und der Gallenblase entdeckt, der wegen eines Büschels an Mikrovilli auf seiner Oberfläche als „Bürstenzelle“ („brush cell“) bezeichnet wurde, dessen Funktion aber bis heute ungeklärt ist. Ähnliche, obwohl nicht identische Zellen wurden auch in weiteren Abschnitten des Magen-Darm-Trakts (dort als „tuft cell“ bezeichnet), in den oberen und unteren Atemwegen, in der Urethra, und jüngst auch im Thymus gefunden. Viele Bürstenzellen exprimieren Geschmacksrezeptoren der Familien Tas1R und Tas2R, sowie die weitere Signaltransduktionskaskade, wie sie aus den Geschmacksknospen der Zunge und des Rachens für die Wahrnehmung der Qualitäten „bitter“, „süß“ und „umami“ bekannt sind. Im Magen-Darm-Trakt werden diesen einzeln im Epithel liegenden chemosensorischen Zellen mittlerweile vielfältige integrative Funktionen in der immunologischen Abwehr bei Wurminfektionen, aber auch für den Virustropismus und im Krebsgeschehen zugesprochen. Für die Nase, die Trachea und die Urethra konnte hingegen gezeigt werden, dass dort die chemosensorischen Zellen der Wahrnehmung von potenziell schädlichen Substanzen, einschließlich bakterieller Produkte, auf der Schleimhautoberfläche dienen und daraufhin über die Freisetzung von Acetylcholin organspezifische Schutzreflexe einleiten. Wir interpretieren solche Bürstenzellen als Wächterzellen an mukosalen Oberflächen, die zur Detektion schädlicher Substanzen, insbesondere aber von Mikroben dienen und diese möglichst eliminieren helfen sollen. Entsprechend diesem Konzept und gestützt durch unsere Vorbefunde formulieren wir die Hypothese, dass die Bürstenzellen der Gallenwege/-blase Wächterzellen für die Aszension von Darmkeimen in das hepatobiliäre System sind. Solche Aszensionen können zu akuten und chronischen Infekten führen mit schwerwiegenden Konsequenzen bis hin zur Sepsis; chronische bakterielle Besiedlung ist insbesondere auch ein bedeutender Risikofaktor bei der Entstehung eines Gallenblasencarcinoms.
In weiteren Kooperationsprojekten wird die Funktion von Bürstenzellen im respiratorischen Trakt, im Urogenitalsystem sowie im Thymus untersucht.
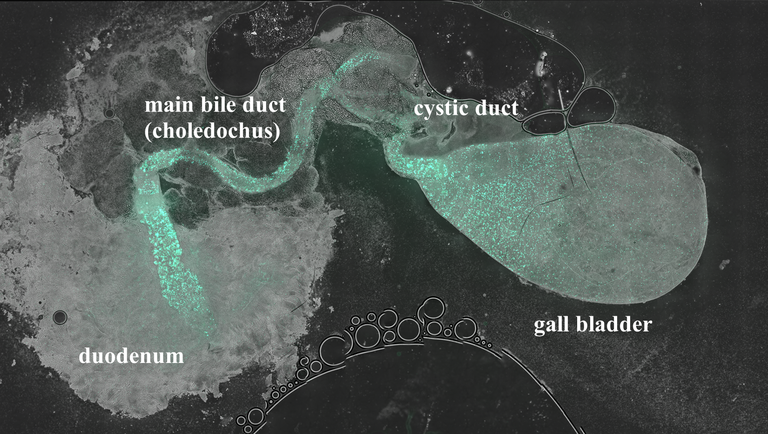
Abbildung 1: Vorkommen und Verteilung cholinerger Bürstenzellen im biliären System der Maus. Bürstenzellen wurden durch transgene Expression eines grün fluoreszierenden Proteins (EGFP) sichtbar gemacht.
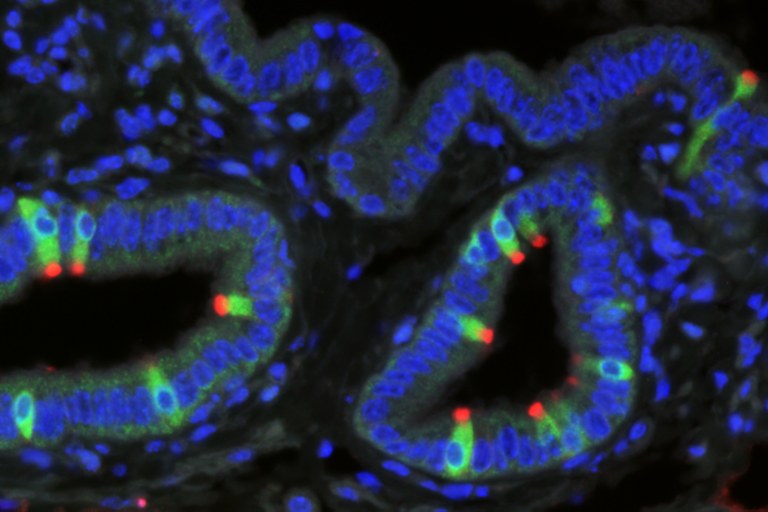
Abbildung 2: Biliäre Bürstenzellen synthetisieren cysteinyl Leukotriene. Drei-Kanal-Fluoreszenzimmunhistochemie der Gallenblase der Maus. Bürstenzellen im Epithel exprimieren das 5-Lipoxygenase-aktivierende Protein (grün, ganzer Zellkörper markiert), sowie Advillin (rot, Marker für Bürstenzellen, v.a. im apikalen Büschel lokalisiert). Zellkerne wurden mit DAPI (blau) dargestellt.
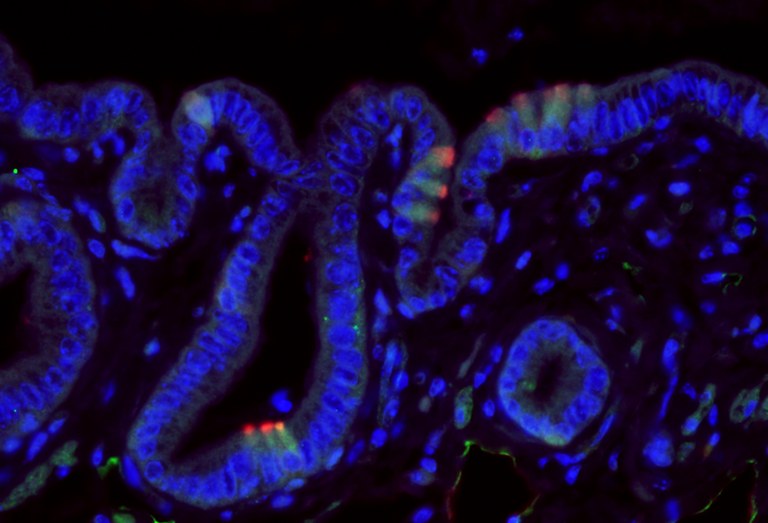
Abbildung 3: Biliäre Bürstenzellen synthetisieren Acetylcholin. Drei-Kanal-Fluoreszenzimmunhistochemie der Gallenblase der Maus. Epitheliale Bürstenzellen exprimieren das Enzym Cholinacetyltransferase (grün), sowie Advillin (rot). Zellkerne wurden mit DAPI (blau) dargestellt.
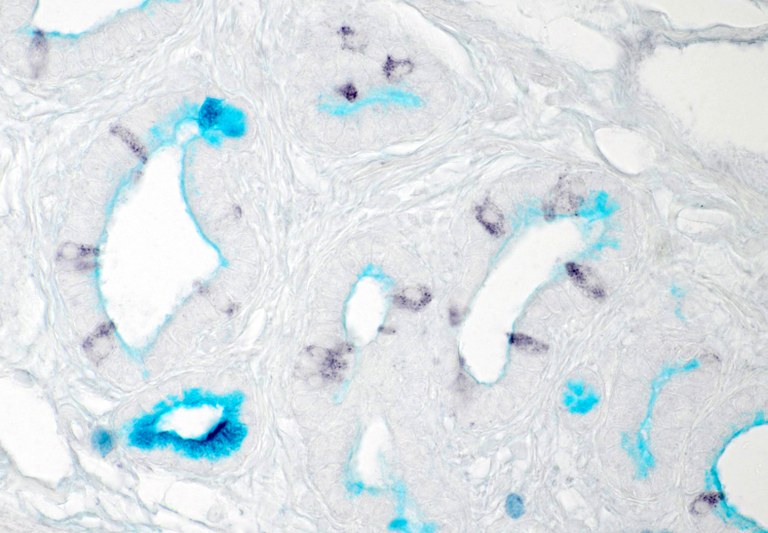
Abbildung 4: Cholinerge Bürstenzellen der Gallenblase (immunhistochemischer Nachweis) liegen in direkter Nachbarschaft zu Schleim-produzierenden Cholangiozyten (Alzianblau-Färbung).
Mitarbeiter:innen: Anna-Lena Ruppert (M.Sc., bis 2020, PhD in 2023), Julia Mahnke (cand. med.), Sarah Winterberg (M.Sc., bis 2020)
Kooperationspartner:innen: Prof. Wolfgang Kummer/PD Dr. Klaus Deckmann, JLU Gießen; Prof. Alexander Visekruna, PU Marburg; Prof. Kristin Rattay, Kiel; Dr. Alexander Perniss, Harvard, Boston, USA; Dr. Maryam Keshavarz, Augsburg.
Eigene Publikationen zum Projektbereich:
- Schmidt P, Pfeil U, Lafee M, Petersen S, Perniss A, Keshavarz M, Das D, Wyatt A, Boehm U, Schütz B, Kummer W, Deckmann K (2025) Tuft cells trigger neurogenic inflammation in the urethra. Cell Rep. Sep 30;44(10):116370. doi: 10.1016/j.celrep.2025.116370. Epub ahead of print. PMID: 41032411
- Mahmoud W, Perniss A, Poharkar K, Keshavarz M, Gärtner U, Oberwinkler J, Schütz B, Worzfeld T, Offermanns S, Kummer W (2025) Differential expression of villin and advillin by neuroendocrine and tuft cells in the murine lower airways. Cell Tissue Res. https://doi.org/10.1007/s00441-025-04003-y.
- Krause FF, Mangold KI, Ruppert AL, Leister H, Hellhund-Zingel A, Lopez Krol A, Pesek J, Watzer B, Winterberg S, Raifer H, Binder K, Kinscherf R, Walker A, Nockher WA, Taudte RV, Bertrams W, Schmeck B, Kühl AA, Siegmund B, Romero R, Luu M, Göttig S, Bekeredjian-Ding I, Steinhoff U, Schütz B, Visekruna A (2024) Clostridium sporogenes-derived metabolites protect mice against colonic inflammation. Gut Microbes 16 (1), 2412669, doi: 10.1080/19490976.2024.2412669
- Keshavarz M, Ruppert AL, Meiners M, Poharkar K, Liu S, Mahmoud W, Winterberg S, Hartmann P, Mermer P, Perniss A, Offermanns S, Kummer W, Schütz B (2024) Bitter tastants relax the mouse gallbladder smooth muscle independent of signaling through tuft cells and bitter taste receptors. Sci. Rep. 14(1):18447.
- Perniss A, Boonen B, Tonack S, Thiel M, Poharkar K, Alnouri MW, Keshavarz M, Papadakis T, Wiegand S, Pfeil U, Richter K, Althaus M, Oberwinkler J, Schütz B, Boehm U, Offermanns S, Leinders-Zufall T, Zufall F, Kummer W (2023) A succinate/SUCNR1-brush cell defense program in the tracheal epithelium. Sci. Adv. 9, eadg8842. DOI: 10.1126/sciadv.adg8842
- Keshavarz M, Faraj Tabrizi S, Ruppert A-L, Pfeil U, Schreiber Y, Klein J, Brandenburger I, Lochnit G, Bhushan S, Perniss A, Deckmann K, Hartmann P, Meiners M, Mermer P, Rafiq A, Winterberg S, Papadakis T, Thomas D, Angioni C, Oberwinkler J, Chubanov V, Gudermann T, Gärtner U, Offermanns S, Schütz B*, Kummer W* (2022) Cysteinyl leukotrienes and acetylcholine are biliary tuft cell cotransmitters. Sci. Immunol. Mar 4;7(69):eabf6734. doi:10.1126/sciimmunol.abf6734. *Co-corresponding authors.
- Perniss A, Schmidt P, Soultanova A, Papadakis T, Dahlke K, Voigt A, Schütz B, Kummer W, Deckmann K (2021) Development of epithelial cholinergic chemosensory cells of the urethra and trachea of mice. Cell Tissue Res. doi: 10.1007/s00441-021-03424-9.
- Ruppert AL, Keshavarz M, Winterberg S, Oberwinkler J, Kummer W, Schütz B (2020) Advillin is a tuft cell marker in the mouse alimentary tract. J. Mol. Hist. 51(4), 421-435; doi: 10.1007/s10735-020-09893-6.
- Perniss A, Liu S, Boonen B, Keshavarz M, Ruppert AL, Timm T, Pfeil U, Soultanova A, Kusumakshi S, Delventhal L, Aydin Ö, Pyrski M, Deckmann K, Hain T, Schmidt N, Ewers C, Günther A, Lochnit G, Chubanov V, Gudermann T, Oberwinkler J, Klein J, Mikoshiba K, Leinders-Zufall T, Offermanns S, Schütz B, Boehm U, Zufall F, Bufe B, Kummer W (2020) Chemosensory cell-derived acetylcholine drives tracheal mucociliary clearance in response to virulence-associated formyl peptides. Immunity 52(4):683-699. doi: 10.1016/j.immuni.2020.03.005.
- Schütz B, Ruppert AL, Strobel O, Lazarus M, Urade Y, Büchler MW, Weihe E (2019) Distribution pattern and molecular signature of cholinergic tuft cells in human gastro-intestinal and pancreatic-biliary tract. Sci. Rep. 9:17466.
- Schütz B, Jurastow I, Bader S, Ringer C, von Engelhardt J, Chubanov V, Gudermann T, Diener M, Kummer W, Krasteva-Christ G, Weihe E (2015) Chemical coding and chemosensory properties of cholinergic brush cells in the mouse gastrointestinal and biliary tract. Front. Physiol. 6:87.
- Krasteva-Christ G, Soultanova A, Schütz B, Papadakis T, Weiss C, Deckmann K, Rafiq A, Chubanov V, Gudermann T, Voigt A, Meyerhof W, Weihe E, Kummer W (2015) Identification of cholinergic chemosensory cells in mouse tracheal and laryngeal glandular ducts. Int. Immunopharm. 29(1):158-65.
- Panneck AR, Rafiq A, Schütz B, Soultanova A, Deckmann K, Chubanov V, Gudermann T, Weihe E, Krasteva-Christ G, Grau V, del Rey A, Kummer W (2014) Cholinergic epithelial cell with chemosensory traits in murine thymic medulla. Cell Tissue Res. 358:737-748.
- Deckmann K, Filipski K, Krasteva-Christ G, Fronius M, Althaus M, Rafiq A, Papadakis T, Renno L, Jurastow I, Wessels L, Schütz B, Weihe E, Chubanov V, Gudermann T, Klein J, Bschleipfer T, Kummer W (2014) Bitter triggers acetylcholine release from polymodal urethral chemosensory cells and bladder reflexes. Proc. Natl. Acad. Sci. USA 111(22):8287-8292.
- Krasteva G, Hartmann P, Papadakis T, Bodenbenner M, Wessels L, Weihe E, Schütz B, Langheinrich AC, Chubanov V, Gudermann T, Ibanez-Tallon I, Kummer W (2012) Cholinergic chemosensory cells in the auditory tube. Histochem. Cell Biol. 137:483-497.
- Krasteva G, Canning B, Hartmann P, Veres T, Papadakis T, Mühlfeld C, Schliecker K, Tallini Y, Braun A, Hackstein H, Baal N, Weihe E, Schütz B, Kotlikoff M, Ibanez-Tallon I, Kummer W (2011) Cholinergic chemosensory cells in the trachea regulate breathing. Proc. Natl. Acad. Sci. USA 108(23):9478-9483.
Für eine komplette Publikationsliste siehe: https://www.webofscience.com/wos/author/record/1873342