06.03.2023 Wie Zellen sich entleeren
Team aus der Marburger Medizin erforschte den molekularen Mechanismus der exokrinen Sekretion
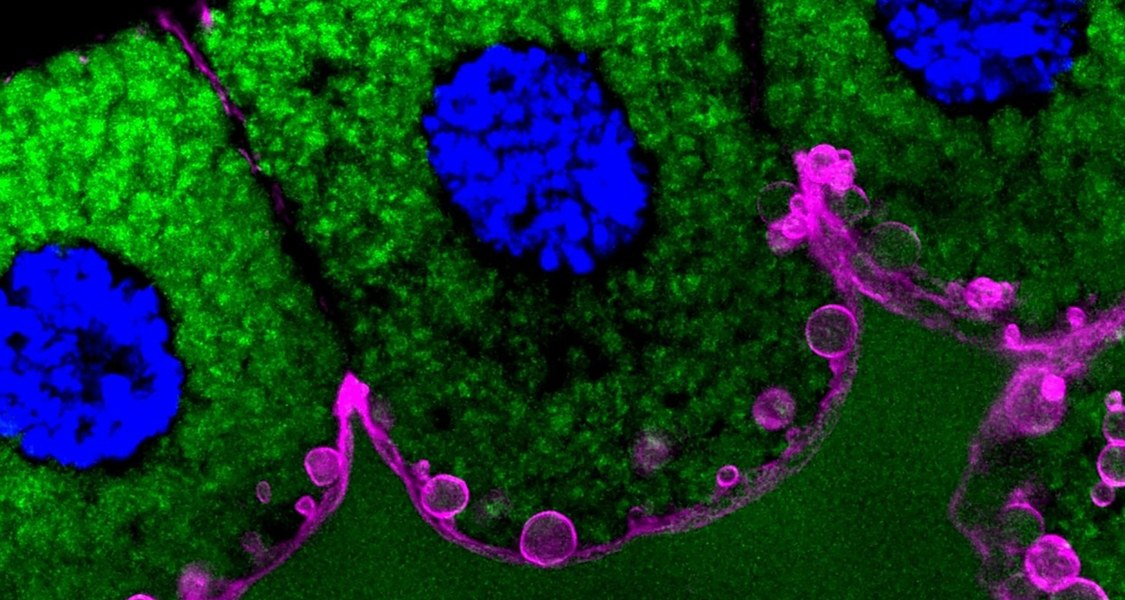
Das Protein EFhD2/Swip-1 trägt bei Fruchtfliegen zur kontrollierten Absonderung von Sekreten bei und könnte beim Menschen an Fehlfunktionen von Nervenverknüpfungen beteiligt sein. Das hat eine Arbeitsgruppe aus der Marburger Hochschulmedizin herausgefunden, indem sie Experimente an Drüsenzellen von Fruchtfliegen durchführte. Das Team berichtet im Fachblatt „Journal of Cell Science“ über seine Ergebnisse.
„Zellen nutzen den strikt geregelten Prozess der Exozytose, um Moleküle aus dem Zellinneren nach außen zu schleusen“, erklärt der Marburger Physiologieprofessor Dr. Sven Bogdan. Die Zellen verpacken dabei Moleküle in membranumhüllte Bläschen – die Fachleute sprechen von Vesikeln –, die anschließend mit der Außenhülle der Zelle verschmelzen, wobei der Inhalt der Bläschen in die Umgebung gelangt.
Der gesamte Vorgang – die Herstellung der Vesikel, ihr Transport durch die Zelle, die Verschmelzung mit der Außenhülle samt Absonderung des Vesikelinhalts – beruhen auf den Bewegungen des Zellskeletts, das aus Fäden des Moleküls Aktin besteht. Bogdan und seine Mitarbeiterin Dr. Franziska Lehne erforschten den Prozess an Speicheldrüsenzellen der Fruchtfliege Drosophila.
Insbesondere untersuchte das Forschungsteam das Protein EFhD2/Swip-1, von dem man weiß, dass es an Aktin bindet. „Das Protein ist an verschiedenen zellulären Prozessen beteiligt, so an der Wanderung von Zellen, an der Krebsausbreitung und am Wundverschluss der Haut“, legt Koautorin Franziska Lehne dar.
Das Team stellte fest, dass EFhD2/Swip-1 vermehrt in Drüsenzellen von Drosophila vorkommt. Das Protein tritt zusammen mit Aktin auf, wenn sich Vesikel bilden. „EFhD2/Swip-1 wird nicht für die Vereinigung von Vesikeln zu größeren Bläschen benötigt, sondern eher für die Zusammenziehung der Vesikelhülle, wodurch der Inhalt freigesetzt wird“, führt Lehne aus.
„Die Befunde sind auch deswegen von Belang, weil das Pendant von EFhD2/Swip-1 beim Menschen eine Reihe von krankhaften Störungen begleitet“, ergänzt Bogdan. „Das Protein gilt daher als möglicher Biomarker für chronische Krankheiten; das betrifft zum Beispiel Fehlfunktionen von Nervenverbindungen, die ihre chemische Kommunikation ja auch mithilfe von Vesikeln bewerkstelligen.“
Professor Dr. Sven Bogdan lehrt Physiologie und Pathophysiologie am Fachbereich Medizin der Philipps-Universität. Dr. Franziska Lehne gehört seiner Arbeitsgruppe als Wissenschaftlerin an. Die Deutsche Forschungsgemeinschaft förderte die zugrundeliegende Forschungsarbeit finanziell.
Originalveröffentlichung: Franziska Lehne & Sven Bogdan: EFhD2/Swip-1 promotes exocytosis of glue granules in the exocrine Drosophila salivary gland, Journal of Cell Science 2023, DOI: https://doi.org/10.1242/jcs.260366
Kontakt
Prof. Dr. Sven Bogdan