26.02.2019 Angriff von der Seite hemmt Teilchenfluss
Internationales Forschungsteam findet neuartige Wirkungsweise eines Medikaments, das Ionenkanäle stilllegt
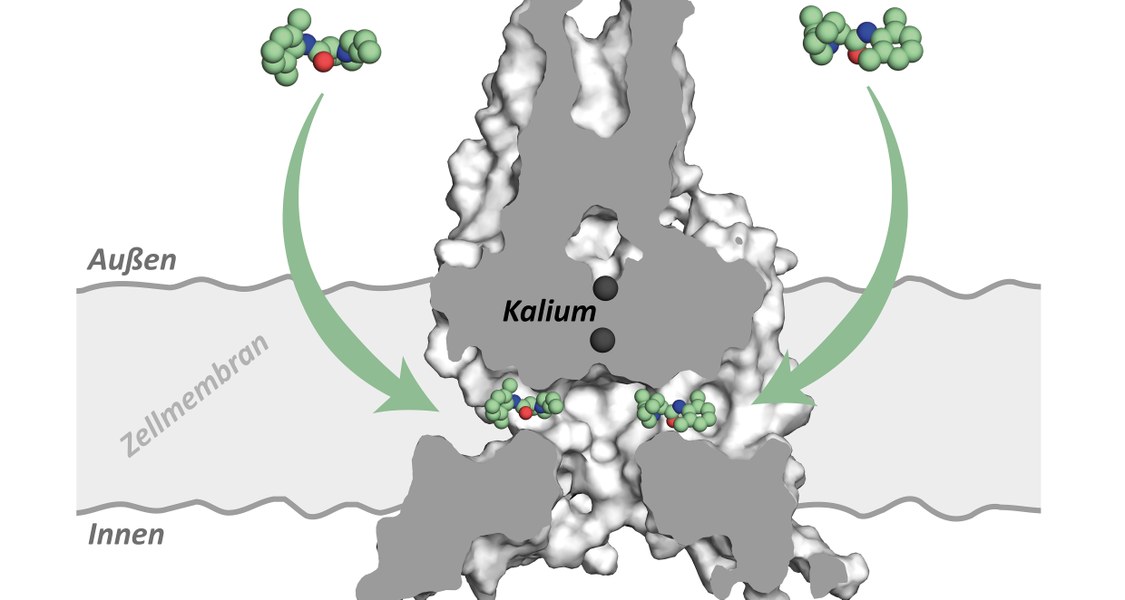
Zielgerichtete Blockade aus dem Hinterhalt: Ein neu entdeckter Mechanismus, mit dem sich Ionenkanäle zielgerichtet blockieren lassen, weckt die Hoffnung auf Behandlungsmöglichkeiten bei Vorhofflimmern und weiteren Erkrankungen. Das schreibt eine Forschungsgruppe unter Marburger Leitung im Wissenschaftsmagazin „eLife“. Das Team ist auch an einem aktuellen Aufsatz in der Zeitschrift „Science“ beteiligt, in dem es ebenfalls um die molekulare Steuerung von Kaliumkanälen geht.
Ob Herzrhythmusstörungen oder Atemstillstände während des Schlafs – so unterschiedlich diese Krankheitsbilder auch sind, eines haben sie gemeinsam: Sie lassen sich wahrscheinlich durch Ionenkanäle beeinflussen, die für die elektrische Erregbarkeit der Zellen zuständig sind, speziell die sogenannten TASK-Kanäle. „Bislang gibt es keine Medikamente, die genau diese Ionenkanäle zielgerichtet blockieren“, erklärt der Physiologe Professor Dr. Niels Decher von der Philipps-Universität, der die Studie leitete. „Daher besteht ein hoher medizinischer Bedarf, neue Angriffspunkte an diesen Kanälen zu finden und neuartige Mechanismen zu entdecken, die zu ihrer Blockade führen.“
Viele unserer Körperfunktionen beruhen auf elektrischen Signalen, etwa die Nerventätigkeit oder der Herzschlag. Die elektrischen Signale kommen dadurch zustande, dass sich im Inneren von Zellen andere elektrisch geladene Teilchen befinden als außerhalb, so genannte Ionen. Für die ungleiche Verteilung sorgen Kanäle, durch die elektrisch geladene Teilchen von einer Seite der Membran auf die andere gelangen; auf diese Weise baut sich ein elektrisches Potenzial über der Membran auf, die jede Zelle umhüllt.

Das Team suchte anschließend nach der Stelle, an der Bupivakain ansetzt, wenn es den Kanal blockiert. Die Wissenschaftlerinnen und Wissenschaftler nutzten hierfür molekulare Techniken, aber auch computergestützte Simulationsverfahren. Das Ergebnis: Das Narkosemittel greift an einer seitlichen Einbuchtung an, die von der zentralen Durchflussöffnung des Kanals abzweigt. „Erstaunlicherweise befindet sich das Medikament so weit seitlich in dieser Höhlung, dass es keinen Porenverschluss des Zentralkanals verursacht“, erläutert Rinnés Kollege Dr. Aytuğ K. Kiper, der sich mit ihr die Erstautorenschaft teilt.
„Was wir entdeckt haben, ist ein ganz neuer Mechanismus, der noch nie zuvor geschildert wurde“, legt Decher dar. Bisherige Kanal-Hemmstoffe greifen bevorzugt an der zentralen Tunnelöffnung an; da diese bei allen Kanaltypen vorkommt, wirken solche Substanzen nicht zielgerichtet, sondern auf alle Kanaltypen gleichermaßen. „Die von uns entdeckte Bindungsstelle und der bislang unbekannte Hemm-Mechanismus können künftig dazu verwendet werden, zielgerichtete Kanalblocker zu finden, die dringend für die Therapie des Atemstillstands im Schlaf und des Vorhofflimmerns benötigt werden“, führt der Studienleiter aus.
Fast gleichzeitig berichtet ein internationales Forschungsteam in der Wissenschaftszeitschrift „Science“ über einen molekularen Mechanismus, der die Öffnung von Kaliumkanälen unterschiedlichen Typs bewirkt. Auch an dieser Veröffentlichung hat das Marburger Team mitgewirkt.
Niels Decher lehrt Physiologie an der Philipps-Universität. Neben seiner Arbeitsgruppe beteiligten sich an der Studie weitere Wissenschaftlerinnen und Wissenschaftler von der Universität Kiel sowie aus Oxford und Chile. Die Deutsche Forschungsgemeinschaft sowie die chilenische Förderorganisation „FONDECYT“ unterstützten die zugrunde liegenden Arbeiten finanziell.
Originalveröffentlichungen:
Susanne Rinné, Aytuğ K. Kiper & al.: The molecular basis for an allosteric inhibition of K+-flux gating in K2P channels, eLife 2019, DOI: https://doi.org/10.7554/eLife.39476
Marcus Schewe, Han Sun & al.: A Pharmacological Master Key Mechanism that Unlocks the Selectivity Filter Gate in K+ Channels, Science 363 (2019), pp. 875-880, DOI: 10.1126/science.aav0569