02.10.2020 Schimmelpilz korrigiert sich selbst
Team aus der Marburger Pharmazie klärte komplizierte Naturstoffsynthese auf
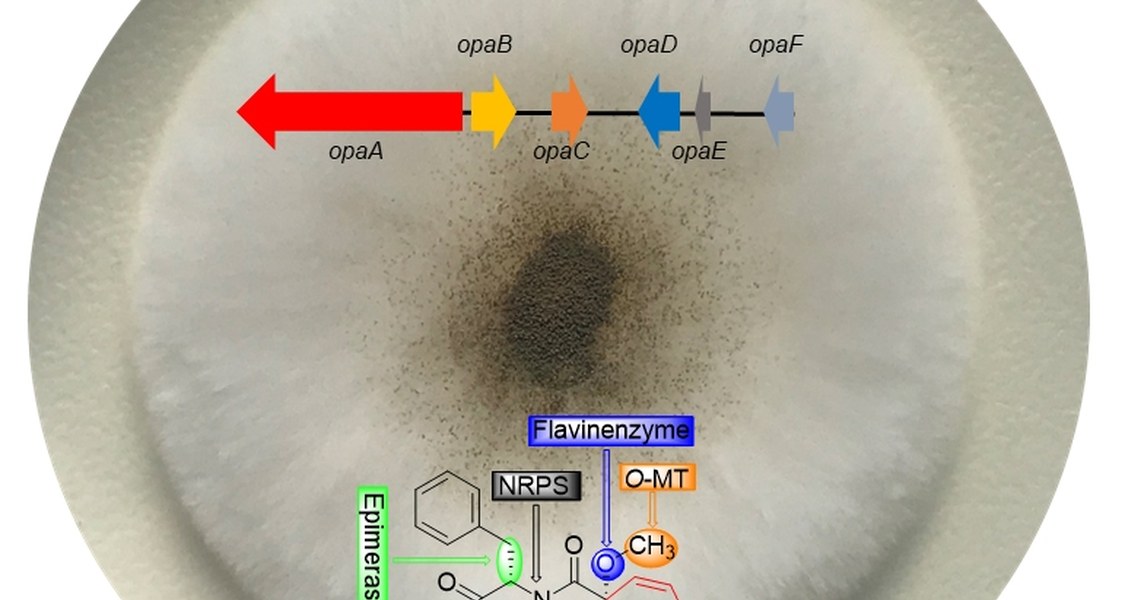
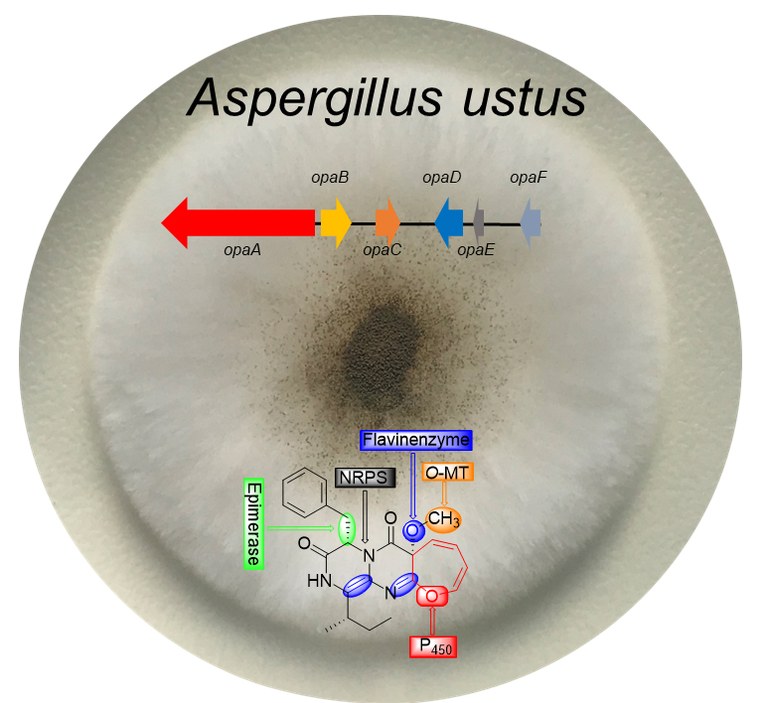
Das Ergebnis muss stimmen: Wenn der Schimmelpilz Aspergillus ustus den Naturstoff Oxepinamid F herstellt, verdreht er zunächst eine Bindung, die er später wieder in die Ausgangslage zurechtrückt. Wie kompliziert der Weg von der Ausgangssubstanz zum fertigen Molekül ist, hat ein internationales Team aus der Pharmazie nun beleuchtet. Die Gruppe berichtet im Forschungsmagazin „Nature Communications“ über ihre Ergebnisse.
Oxepinamide sind Naturstoffe, die vor allem in Pilzen vorkommen. Manche der Moleküle gelten als Kandidaten für Medikamente, zum Beispiel für die Behandlung der Alzheimerschen Krankheit, von Diabetes, Artheriosklerose und Entzündungen. „Daher besteht ein großes Interesse daran, solche Stoffe zu entdecken und zu erforschen, wie sie entstehen“, erklärt der Pharmazeut Professor Dr. Shu-Ming Li von der Philipps-Universität Marburg, der die Forschungsarbeiten leitete.
Das Team nahm sich das Molekül Oxepinamid F vor, von dem bislang nicht bekannt war, wie ihre Herstellung im Gießkannenschimmel Aspergillus ustus vonstattengeht. „Wir haben mit molekularbiologischen und biochemischen Methoden nachgewiesen, dass ein Cytochrom P450-Enzym für die Biosynthese der Oxepin-Kernstruktur aus einem Benzolring verantwortlich ist“, erläutert Li. „Dafür wird die räumliche Anordnung der Ausgangssubstanz zunächst verändert, jedoch später wieder rekonstruiert, nachdem weitere Enzyme zum Einsatz gekommen sind.“
Professor Dr. Shu-Ming Li lehrt Pharmazeutische Biologie an der Philipps-Universität Marburg. Neben seiner Arbeitsgruppe beteiligte sich an der Studie auch Professorin Dr. Aili Fan von der Beijing Universität für Chemische Technologien, eine ehemalige Marburger Doktorandin. Die Deutsche Forschungsgemeinschaft sowie das Stipendienprogramm „China Scholarship Council“ des chinesischen Bildungsministeriums unterstützten die zugrundeliegende Forschungsarbeit finanziell.
Originalveröffentlichung: Liujuan Zheng, Haowen Wang & al.: Oxepinamide F biosynthesis involves enzymatic D-aminoacyl epimerization, 3H-oxepin formation, and hydroxylation induced double bond migration, Nature Communications 2020, DOI: https://doi.org/10.1038/s41467-020-18713-0
Kontakt
Professor Dr. Shu-Ming Li
Tel.: 06421-2822461
Mail: shuming.li@staff.uni-marburg.de
Institut für Pharmazeutische Biologie und Biotechnologie