Hauptinhalt
Kurzdarstellung unserer Forschungsschwerpunkte – Abteilung Bogdan
Die Gestaltbildung und Erhaltung von Geweben und Organen erfordern dynamische Veränderungen und Anpassungen der Zellform und der Zellmotilität. Die Untersuchung des Zytoskeletts und der beteiligten Moleküle, Signalproteinkomplexe sowie regulatorischen Mechanismen sind daher wesentlich für ein tiefgreifendes Verständnis der molekularen Zellbiologie von Geweben und Organen und der Pathologie menschlicher Erkrankungen wie Infektionen, akute und chronische Entzündungen, Immunerkrankungen und maladaptive Remodellingprozesse. Zur Untersuchung dieser Prozesse verbinden wir in unseren experimentellen Strategien die Physiologie gleichermaßen mit der Drosophila Genetik, der Zellbiologie. sowie hochauflösende, bildgebende Techniken (3D-SIM, 4D-SDM, LSM, Light-Sheet Mikroskopie) und Einzel-Zell RNA-Analysen.
Weiterführende Informationen und Kontakt finden Sie auf den Seiten des Instituts für Physiologie und Pathophysiologie.
Folgende Module der AG Bogdan sind Teil der Studiengänge Humanbiologie BSc. und MSc.:

Inhalt ausklappen Inhalt einklappen A. Molekularen Mechanismen der Dynamik und Plastizität der angeborenen Immunantwort
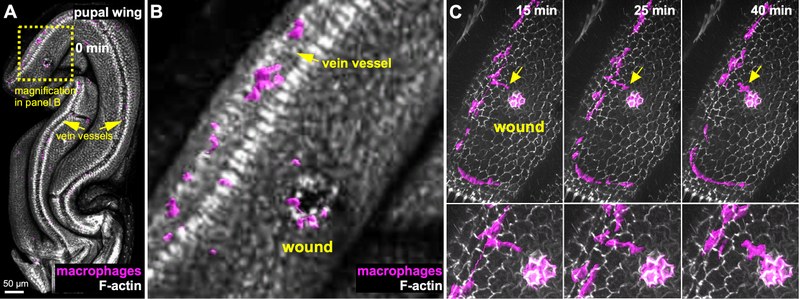
Das angeborene Immunsystem ist auf eine Vielzahl konservierter zellulärer und molekularer Strategien angewiesen, um die Abwehr von Krankheitserregern, den Gewebeumbau und die Reparatur zu vermitteln. Drosophila ist ein geeigneter genetischer Modellorganismus zur Untersuchung der Blutzellenentwicklung und der angeborenen Immunität. Ähnlich wie bei Säugetieren beruht die erste Verteidigungslinie gegen eindringende Krankheitserreger und Wunden bei Drosophila sowohl auf einer humoralen Reaktion, durch die Effektor-Moleküle wie antimikrobielle Peptide in die Hämolymphe sezerniert werden, als auch auf einer zellulären Reaktion, bei der Krankheitserreger von Blutzellen phagozytiert werden. insbesondere Makrophagen. Wir haben Drosophila Makrophagen als hervorragendes Modellsystem etabliert, das viele Vorteile kultivierter Zellen mit einem genetischen In-vivo-Modellsystem zur Untersuchung der konservierten Genfunktion bei der Einzelzellmigration und der Immunzellreaktion bei Verwundung kombiniert. Mithilfe verschiedener RNAi- und Überexpressionsansätze haben wir zuvor zahlreiche Zytoskelett- und Signalmoleküle identifiziert, die die Morphologie und Motilität von Immunzellen steuern.
Vor kurzem haben wir damit begonnen, Einzelzell-Transkriptomik und hochauflösende Mikroskopie zu kombinieren, um die Heterogenität und Plastizität von Drosophila Blutzellen weiter zu untersuchen. Wir identifizierten undifferenzierte und spezifizierte Hämozyten mit unterschiedlichen molekularen Signaturen, die mit unterschiedlichen Funktionen wie antimikrobieller, antimykotischer Immunabwehr, Zelladhäsion oder Sekretion verbunden sind. Unsere Daten stellen die erste molekulare Beschreibung der Blutzellen von Drosophila Puppen dar und liefern erste Einblicke in die funktionelle Diversifizierung und Plastizität von Blutzellen während der Entwicklung.
Mehr zum Thema kann unter den Pressemitteilungen der Uni Marburg nachgelesen werden und im Podcast gehört werden.
Inhalt ausklappen Inhalt einklappen B. Wechselwirkungen zwischen Epithel- und Immunzellen bei der epidermalen Verwundung
Epithelien bilden hochselektive Barrieren, die die meisten unserer Organe auskleiden. Die Schutzfunktion des Epithels beruht auf seiner bemerkenswerten Fähigkeit, die Barrierefunktion und die Gewebehomöostase wiederherzustellen, aber auch auf einer komplexen Wechselwirkung zwischen Epithelzellen und infiltrierenden Immunzellen als Reaktion auf Schäden und Infektionen. Bei Verletzungen wurden verschiedene „Alarmsignale“, sogenannte schädigungsassoziierte molekulare Muster (DAMPs), beschrieben, die aus verletztem Epithelgewebe freigesetzt werden (Enyedi und Niethammer, 2015; Niethammer, 2016). Diese frühen Schadenssignale führen zur Rekrutierung von angeborenen Immunzellen, die für die Gewebereinigung aus der lokalen Umgebung erforderlich sind. Anschließend werden weitere Immunzellen aus dem Blutkreislauf in das geschädigte Gewebe rekrutiert, indem sie die vaskulären Endothelbarrieren überwinden, ein Prozess, der als Extravasation bezeichnet wird. Die Extravasation von Immunzellen ist ein chemotaktisch gesteuerter Prozess, der durch zahlreiche Chemokine kontrolliert wird, die entweder von gewebsresidenten Makrophagen oder vom verletzten Gewebe freigesetzt werden.
Um die Wechselwirkungen zwischen Epithel- und Immunzellen bei der Wundheilung und Wiederherstellung der Gewebehomöostase besser zu verstehen, haben wir verschiedene Drosophila Einzel- und Mehrzell-In-vivo-Wundmodelle unter Verwendung entweder der abdominalen Epidermis oder des Flügelepithels früher Puppenstadien etabliert. Außerdem haben wir ein neues „Extravasations”-Wundmodell unter Verwendung späterer Puppenstadien etabliert. Wir nutzen diese Modelle, um konservierte Schlüsselakteure und nachgeschaltete Ereignisse zu identifizieren, die ein komplexes Zusammenspiel zwischen Epithelzellen und infiltrierenden Immunzellen als Reaktion auf Schäden und Infektionen erfordern.
Über dieses Projekt berichtete die Pressestelle der Uni Marburg am 15.07.2026.